의학회 브리핑
◎ 중앙IRB 소개
대한의학회, 개발신약의 신속한 임상진입을 지원하는 중앙임상시험심사위원회 운영
- 2022년부터 전체 질환 의약품 임상시험으로 심사 범위 확대 운영-
대한의학회는 다기관 의약품 임상시험의 총괄 심사를 위한 국가 지정 임상시험심사위원회인 중앙임상시험심사위원회(중앙심사위원회, 중앙IRB)를 운영하고 있다.
중앙심사위원회는 약사법, 약사법 시행령, 의약품 등의 안전에 관한 규칙 및 동 규칙 별표 4 의약품 임상시험 관리기준에 따라 설치 및 운영되는 ‘의약품 임상시험심사위원회’로서 복수의 임상시험실시기관에서 수행하기로 한 임상시험의 통일된 심사가 필요한 경우에 위탁받은 임상시험 실시에 관한 심사 업무를 통해 임상시험이 타당성과 신뢰성을 바탕으로 수행되도록 지원한다.
- ☞ 임상시험 및 임상시험심사위원회란?
- 임상시험은 질병 치료와 예방 등을 위해 개발된 새로운 신약 등의 안전성·유효성을 확증하기 위해 임상시험실시기관(의료기관)에서 시행되는 것으로 식약처 및 실시기관(다기관 임상시험의 경우, 모든 의료기관) 임상시험심사위원회의 임상시험계획 승인이 있어야 시작 가능하다.
* (임상시험심사위원회, IRB) 임상시험에 참여하는 대상자의 권리·안전·복지를 위하여 임상시험계획서, 동의서 등 임상시험 실시에 관한 심사 등 업무를 수행하는 상설위원회
대한의학회는 중앙심사위원회 운영을 위해 임상시험실시기관과의 협약 체결을 통해 상호 협력 체계를 구축하고 있다. 협약을 통해 중앙심사위원회 심사 활동에 참여, 상호 존중, 심사 정보 공유 및 규정 준수 등의 사항에 대해 상호 협력함에 합의함으로써 국내 복수의 임상시험실시기관에서 수행되는 임상시험에서 시험대상자의 권리와 복지를 보호하고 임상시험이 과학적, 윤리적, 효율적으로 수행될 수 있도록 하며, 자원을 효율적으로 이용하여 행정처리 기간을 단축하고, 심사기준의 표준화를 달성하고자 한다.
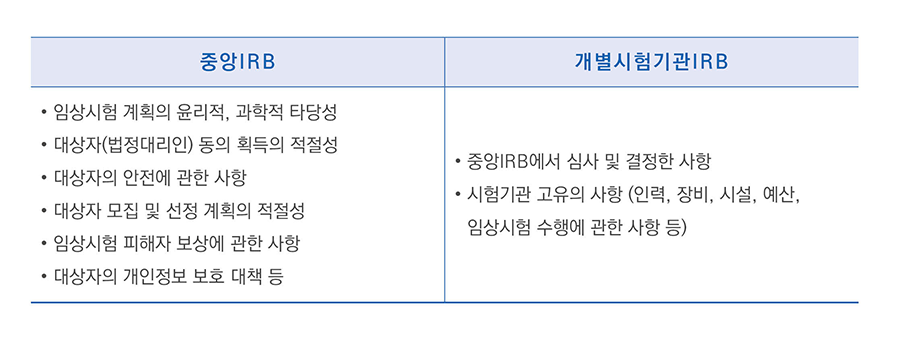
개별 임상시험실시기관은 중앙심사위원회의 심사 결과를 상호 인정하고 기관 특성에 따른 자료 위주로 신속심사를 할 수 있고, 필요한 경우 실시기관 심사위원회에서 추가 심사도 할 수 있으므로, 개별 실시기관의 독립성과 자율성도 보장된다.
대한의학회 중앙심사위원회는 신규과제의 최초 심사부터 계획변경, 중간보고(임상시험 지속여부), 안전성정보 보고, 중지·종료·결과보고, 기타 중앙심사위원회 심사가 필요하다고 판단되는 사항 심사까지 임상시험 전반의 심사업무를 담당하며, 이를 위해 개별 임상시험에 대한 전문적이고 효율적인 심사를 수행하기 위한 독립적 심사기능을 가진 개별임상시험심사위원회(개별심사위원회)를 구성·운영한다. 개별심사위원회는 임상시험 실시기관을 대표하는 심사위원회 위원 및 전문성을 가진 위원이 참석하여 공동임상시험심사위원회 형태로 다기관 임상시험의 윤리적·과학적·의학적 측면을 다각도에서 심도있게 심사한다.
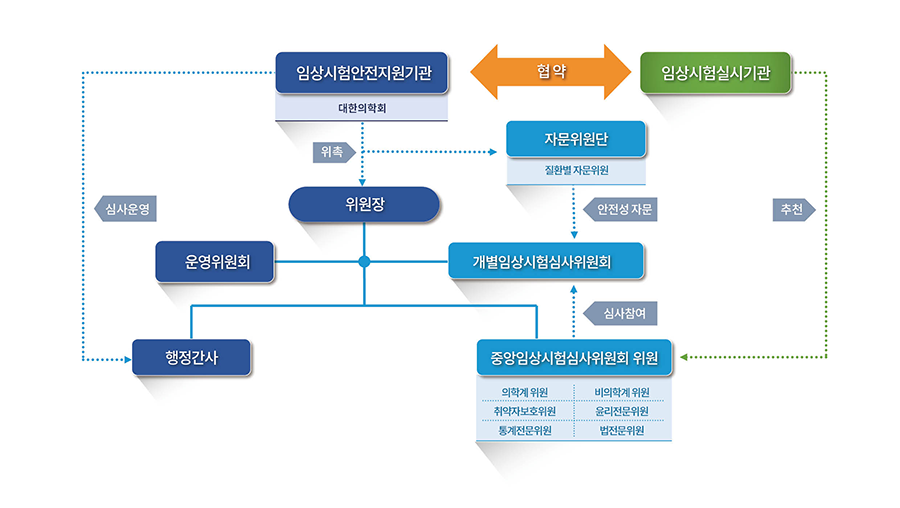
▶ 중앙임상시험심사위원회 위원: 임상시험의 윤리적·과학적·의학적 측면을 검토·평가할 수 있는 경험과 격을 갖춘 사람 중에서 임상시험실시기관의 장 또는 임상시험 관련 학회·단체의 장의 추천을 받아 임상시험안전지원기관장이 위촉한다.
▶ 중앙임상시험심사위원회 위원장: 중앙IRB 상임위원* 중에서 호선으로 선출한다.
* 상임위원: 식약처 임상시험계획 승인 건수 상위 20개 임상시험실시기관 소속의 위원 또는 관련 전문가 요청을 받은 전문 단체로부터 추천 받은 위원으로서 5년 이상의 임상시험 심사위원회의 위원 참여 경험을 가진 자
▶ 개별임상시험심사위원회: 개별 임상시험에 대한 전문적이고 효율적인 심사를 수행하기 위한 독립적 심사기능을 가진 심사위원회로서 임상시험의 특성 및 참여기관 등을 고려하여 중앙IRB 심사위원 중 최소 11인 이상으로 구성된다.
▶ 자문위원: 중앙IRB 위원장은 심의와 관련하여 필요한 경우에는 전문적인 지식과 경험이 있는 관계 전문가를 참석하게 하여 의견을 들을 수 있다.
▶ 운영위원회: 중앙심사위원회 운영과 관련하여 세부사안을 논의하고 필요사항을 결정한다.
▶ 행정간사: 임상시험안전지원기관 소속으로 중앙심사위원회 활동과 관련된 행정처리를 담당함으로써 중앙심사위원회가 효율·효과적으로 운영되도록 한다.
대한의학회는 2022년부터 중앙심사위원회 심사대상 범위를 코로나19(COVID-19) 백신·치료제 및 항암제에서 전체 질환 의약품 임상시험으로 확대하여 운영한다. 이를 통해 다기관 임상시험의 중복되는 행정절차를 줄여 임상시험실시기관의 부담을 경감하는 동시에 제약업계 개발 신약의 신속한 임상 진입을 지원함으로써 환자 치료 기회 확대에 기여하고자 한다. 궁극적으로는 임상시험에 참여하는 대상자의 권리·안전·복지를 위한 안전망을 강화하여 국민보건 향상에 이바지할 수 있을 것으로 기대한다.

※ 임상시험실시기관용 중앙IRB 안내서 및 임상시험의뢰자용 중앙IRB 안내서는 ‘중앙IRB 누리집(cirb.mebica.net) → 안내 사항’에서 확인할 수 있다.

