기획특집 – 신의료기술의 도입과 사용에서 의료기술평가의 역할

이 유 경순천향의대 진단검사의학
- 의학은 불확실성의 과학이고 가능성의 예술이다.
-
의학교육자인 William Osler의 표현이다. 의사는 응급실을 방문한 복통 환자를 충수돌기염 진단으로 결론 짓기까지 문진, 신체 진찰, 혈액검사, 영상검사 등을 동원하여 진단 불확실성을 배제해 간다. 이는 적합한 후속 치료 방침을 결정(medical decision)하고 환자의 건강 회복 가능성을 높이기 위함이나, 그럼에도 불확실성은 항시 존재하여 매 순간 발생 가능한 위험에 대한 설명이 일상적으로 따라 붙는다. 의사라는 면허가 개인에게 주어진다 함은 의과대학 교육과 훈련을 통해 진료 과정에 상존하는 불확실성 대응 능력을 갖추었고, 더불어 환자의 건강 회복을 위해 최선을 다해야 하는 의무가 주어짐이라 생각한다.
의학분야에서는 현장 경험 혹은 연구를 통해 얻은 사실과 결과를 문헌의 형태로 정리하고 축적하기 위한 수 많은 의료인과 연구자의 노력이 지속되어 왔고, 이들이 모여 하나의 정설(定說)로 받아들여져 왔다. 후학들은 이를 근거로 자신의 의료 전문성을 펼치며, 선행 근거를 비판 혹은 지지하는 근거를 추가하여 한때의 정설은 수정 보완되어 바람직한 방향으로 진화하고 이러한 과정이 바로 의학 발전의 역사를 구성한다. 근거기반의학은 폭발적으로 증가하는 의학 연구문헌 중 양질의 연구결과들을 현재의 임상문제에 적용할 수 있는 근거로 합성하고, 이를 양심적이고 명시적이며 현명하게 개별 환자의 진료에 사용하는 것으로 정의할 수 있다.
- 의사는 의료기술에 대한 신뢰를 필요로 한다.
- 환자가 의료기관을 방문하고 진료를 받을 때 기대하는 것은 “건강 회복 혹은 개선”이다. 의사들은 성공적인 의료결과가 만들어지는데 환자와의 “라포형성”을 매우 중요하게 여긴다. 라포는 의사와 환자 사이에 형성된 친밀도라 표현할 수 있지만, 그 기저에는 서로에 대한 공감과 신뢰가 존재한다. 신뢰는 하루 아침에 만들어질 수도 없지만 또 하루 아침에 무너지기도 하여 확보와 유지에 큰 노력과 에너지를 필요로 한다. 의사와 환자 사이에 신뢰가 필요한 만큼이나, 의사는 자신이 환자에게 행할 의료기술에 사용될 약제, 기기, 시약 등에 대한 신뢰를 필요로 한다. “신뢰”라는 단어는 상대방이 정직하고 진실하며 나를 해할 어떤 의도적 행위를 하지 않을 것이라 믿음을 의미한다. 의사가 환자의 치료목적으로 처방(즉, 의료기술)을 시행할 때는 부작용보다는 긍정적 임상 효과를 확신할 때이며, 이러한 확신의 준거로서 객관적이고 과학적 근거를 중시한다. 더불어 그 처방에 사용될 기기나 약제 등의 임상적 효과와 한계를 인지하고, 발생 가능한 위험요인을 파악해야 비로소 유효하고 안전한 진료를 기대할 수 있다. 정리하면, 환자에게 의사가 처방을 내리고 의료행위가 일어난다 함은 환자-의사간의 신뢰뿐 아니라, 의사는 자신의 처방에 포함될 의료기술에 대한 신뢰가 필요한데 이는 처방에 투입될 요소들의 효과와 한계, 내포한 위험요인까지 모두 인지하고 불확실성에 대한 대응이 가능할 때 비로소 기대할 수 있다. 의학에서의 신뢰 형성은 특정 연구자 일방의 주장보다는 과학적 방법론으로 진행한 연구 결과를 통한 주장이어야 하고, 만약 여러 나라 다수의 기관에서 유사한 결과를 확인할 때 신뢰를 넘어 하나의 정설로 굳어지게 된다.
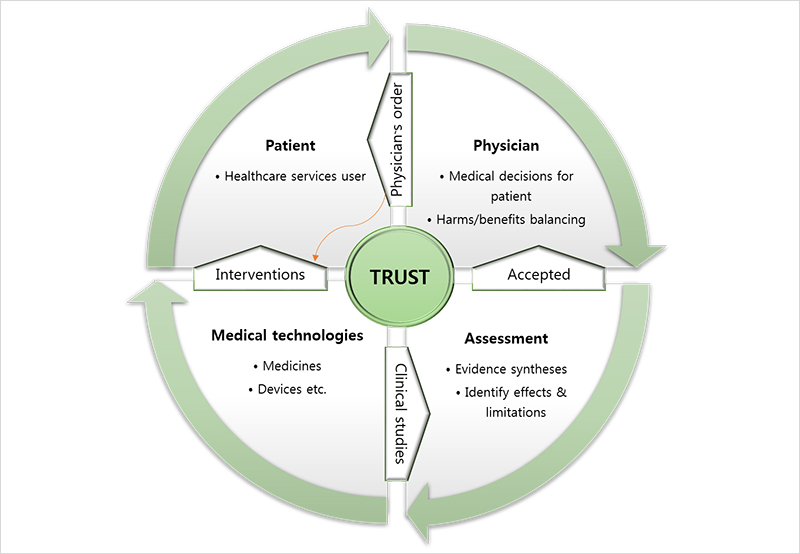 Figure 1. Health technology assessment and trust; Trust is essential in patient healthcare.
Figure 1. Health technology assessment and trust; Trust is essential in patient healthcare.
Physicians are obliged to apply reliable medical technology to patients in the course of their care.
Health technology assessment is how medical technology secures trust.
- 신의료기술의 도입과 의료기술평가
-
의료기술평가(health technology assessment, HTA)는 과학적 근거 자료들을 체계적이며 포괄적이고 비평적 평가를 거쳐 결과를 합성하는 과정이고, 국제적으로 표준화된 방법을 따르도록 되어 있다.
우리나라에서 신의료기술이란 단어를 사용할 때 반드시 함께 이해하고 넘어가야 하는 점은 ‘신의료기술’은 새롭게 개발된 의료기술(newly developed technology)이란 의미와 함께 역사적으로 존재하였음에도 우리나라 보험권에 등재되어 있지 않던 의료기술이 보험회사의 관리항목으로 신규 진입하는 기술(newly listed in health insurance)이란 의미도 포함한다는 점이다. 우리나라 신의료기술평가가 심각한 규제로 인지되는 것에 언어가 갖는 의미의 모호성도 한 몫을 담당했다고 생각한다.
의료현장에서 환자에게 새로운 의료기술을 적용해야 하는 의사 입장에서 임상으로의 도입이 어떠해야 할지를 생각해보면, 의사에게 가장 필요한 것은 의료기술에 대한 신뢰 확보일 것이다. 의료인이 기술을 신뢰하기까지의 과정을 진단법을 들어 간략히 설명하면, 기초연구부터 전임상연구 등의 과정을 통해 개발한 진단법은 제품화의 과정을 거쳐 의료기관의 임상검사실에서 임상적 성능평가 등 검증을 거쳐 규제당국으로부터 시판허가를 득한다. 이후 의료계는 이를 환자진료에 사용할 수 있을 것인가에 대한 검토를 진행하는데, 미국의 경우 AMA에서의 CPT code를 부여하는 평가과정이 이에 해당할 것이다. 우리나라는 신의료기술평가 과정을 통해 평가를 진행하고 의료행위코드를 부여하고 있다. 다음 단계로 이어지는 것이 보험회사에서 보험급여의 범위로 포함할 것인가를 판단하는 과정, 즉 우리나라의 경우 건강보험심사평가원의 경제성평가를 거쳐 건강보험정책심의위원회(일명 건정심)의 의결을 거치는 보험등재 과정이다[Figure 2]. 의료행위코드 부여와 보험자 구매의 과정은 서로 다름을 분명히 인식해야 한다. 그러나 우리나라의 경우 보험회사의 원칙에 의해 보험급여와 비급여를 모두 관리영역에 포함하기 때문에 두 개의 과정을 분리하기 어려운 특징이 있다. 이러한 특징 때문에 우리나라에서 새롭게 시장에 진입하는 의료기술들이 식품의약품안전처의 시판허가를 받았음에도 판매 가능한 시장이 없다는 비판을 받은 주된 이유가 되었다.
의료기술평가는 의료기술이 점차 고가화되고 복잡해지면서 한정된 재정으로 보건의료체계에 적정 의료기술을 합리적으로 판단하여 급여를 결정하고 의료시장에 공급하여 의료비 지출을 효율화하기 위해 만들어진 시스템이다. 이런 정의에서 우리나라의 신의료기술평가는 “보건의료체계에 적정 의료기술을 합리적으로 판단”하여 의료행위코드를 부여 과정으로 의료계가 환자에게 적용을 결심하는 의미로 이해할 수 있다. 다음으로 의료비 지출을 효율화하기 위한 검토는 건강보험심사평가원에서 진행하는 보험등재 과정으로 분리 진행되고 있다.
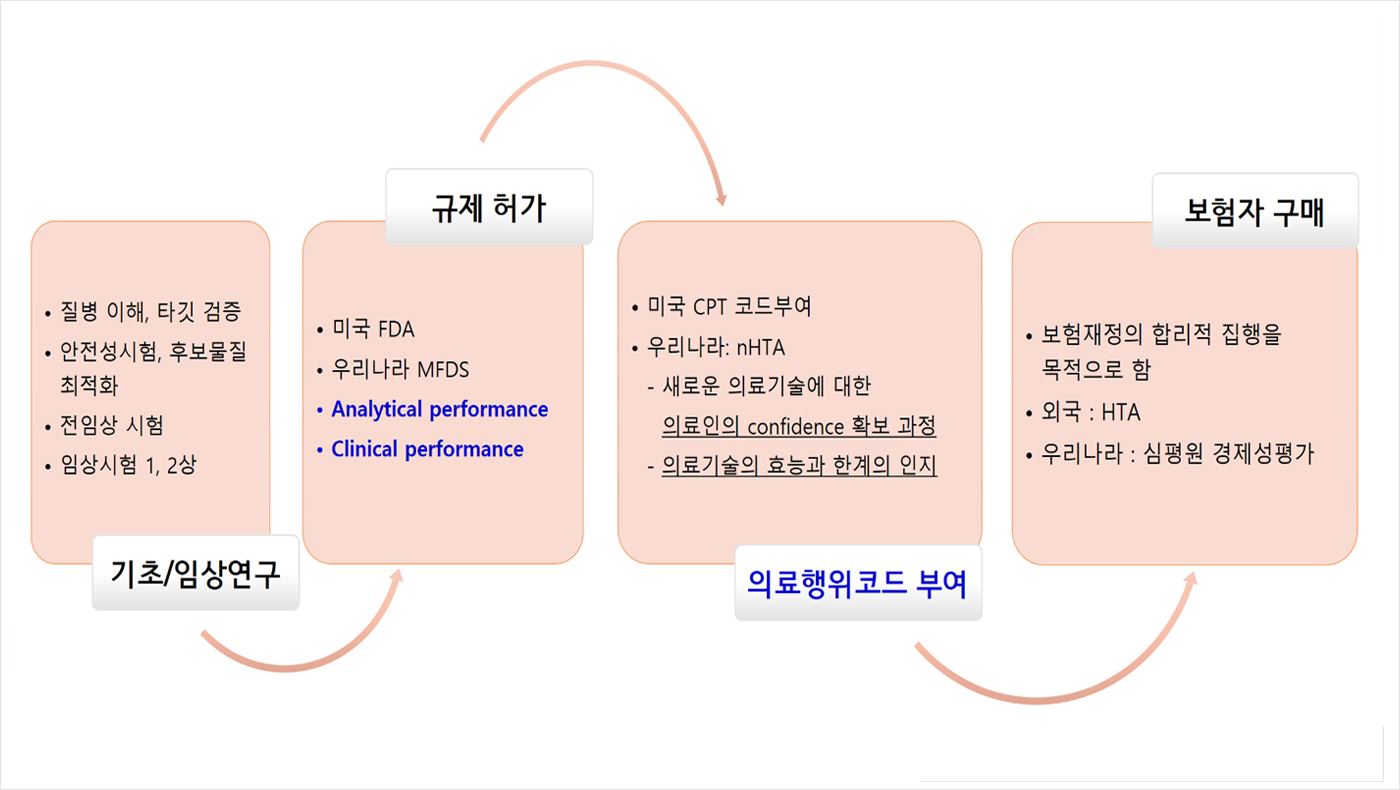 Figure 2. 진단검사법의 개발부터 제품허가, 의료기술코드부여, 보험 등재
Figure 2. 진단검사법의 개발부터 제품허가, 의료기술코드부여, 보험 등재
- 의료기술평가를 의료산업 발전의 파이프라인 측면에서 바라보자.
-
의료기술평가를 의료기술이 의료 현장에 진입하기 위한 수단의 측면에서만 바라본다면, 이는 규제임에 틀림이 없다. 그러나 의료인이 안전하고 유효한 의료기술을 환자에게 행하기 위한 수단 측면으로 그리고 평가 과정에서 발견된 evidence gap을 새로운 임상연구나 제품개발의 정보로 순환시키는 입장에서 바라본다면 전혀 다른 가능성이 존재함을 알 수 있다[Figure 3].
David Cooksey경의 보고서인 “A review of UK health research funding”에 언급한 바에 의하면 영국 국가보건서비스가 의료기술평가로부터 얻은 경험은 의료기술 연구개발 시장 실패에서 확인된 미충족 의료수요와 혁신과 유연성 제고를 위한 고품질의 근거를 의료정책 의사결정권자에게 제공하는데 상당한 기여가 있음을 보고하였다. 또한 질과 효율이 향상된 의료의 수혜 범위를 넓혀야 하는 국가보건서비스 입장의 요구는 의료기술평가 프로그램의 확대를 통해 상당부분 충족될 수 있음을 보고하고 있다. 근거기반의료를 지지하는 의료인의 한 사람으로 우리나라의 의료기술평가를 의료현장의 신뢰 확보 수단 측면에서 그리고 의료산업과 의학 R&D에 기여하는 플레이어 측면에서 이해되고 논의되기를 바란다.
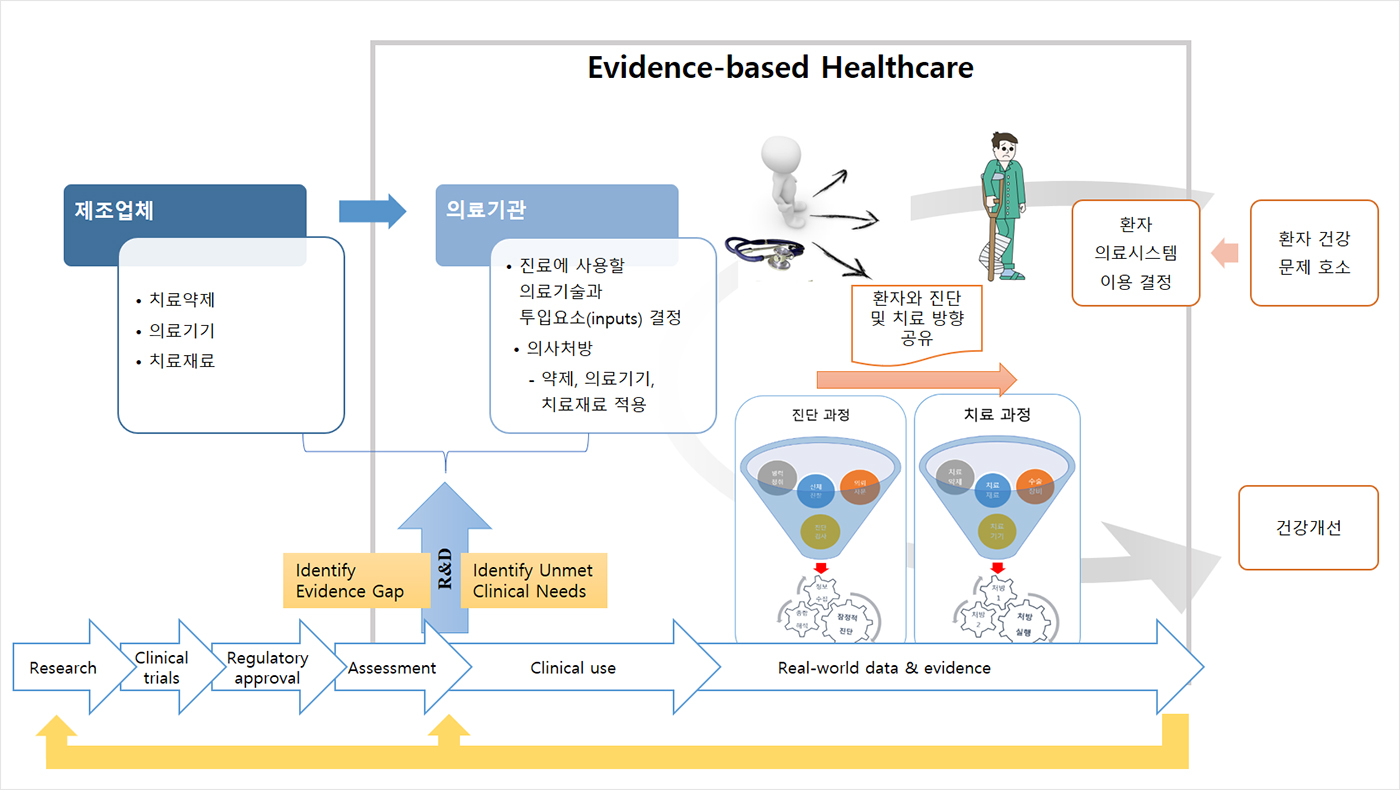 Figure 3. 근거기반의료의 실행과 의료기술 R&D pipeline의 관계 측면에서 의료기술평가
Figure 3. 근거기반의료의 실행과 의료기술 R&D pipeline의 관계 측면에서 의료기술평가
- 참고문헌
-
- 1. Cooksey D. A review of UK health research funding [Internet]. London: Her Majesty’s Stationery Office; 2006 [cited 2018 Nov 13]. Available from: https://www.gov.uk/government/publications/a-review-of-uk-health-research-funding
- 2. Guyatt GH. Evidence-based medicine. ACP J Club 1991;114:A16.
- 3. Osler W, Bean RB, Bean BW. Sir William Osler: aphorisms from his bedside teachings and writings. New York: H. Schuman; 1950.
- 4. Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and what it isn't. BMJ 1996;312:71-72.
- 5. Lee YK. Advanced medical devices and regulatory innovations in new health technology assessments. J Korean Med Assoc 2018;61:702-5.

